Dalam kehidupan sehari-hari kita sering menjumpai senyawa asam dan basa, seperti aspirin dan obat maag cair, walaupun banyak orang yang tidak mengetahui nama kimianya asam asetilsalisilat (aspirin) dan magnesium hidroksida (obat maag cair). Di samping sebagai bahan dasar dari produk rumah tangga dan obat obatan, kimia asam-basa berperan penting dalam proses industri dan sangat diperlukan dalam mempertahankan sistem biologis.
Istilah asam berasal dari bahasa latin yaitu acetum yang berarti cuka. Zat yang bersifat asam antara lain : asam khlorida (HCI), air aki (asam sulfat) dan pembersih porselin, jeruk, lemon, dll.
Secara umum senyawa basa memiliki ciri-ciri sebagai berikut
1. Senyawa asam memiliki rasa masam.
2. Dapat merubah warna indikator misalnya kertas lamus biru menjadi merah.
3. Bersifat korosif terhadap logam.
4. Jika dilarutkan ke dalam air menghasilkan ion hydrogen (H+).
5. Memiliki nilai pH (derajat keasaman) kurang dari 7. Semakin kecil nilai pH suatu zat maka semakin kuat sifat keasamannya.
6. Larutan asam dalam air menghantarkan arus listrik.
Sifat senyawa basa
Istilah basa berasal dari bahasa arab yang berarti abu. Zat yang bersifat basa antara
lain: Natrium Hidroksida (NaOH), Kalium Hidroksida (KOH), pasta gigi dan sabun.
Secara umum
senyawa asam memiliki ciri-ciri sebagai berikut:
1.
Basa memiliki rasa pahit.
2.
Basa terasa licin; misalnya, sabun yang
mengandung basa memiliki sifat ini.
3.
Dapat merubah warna indikator kertas lakmus
merah menjadi biru.
4.
Bersifat kaustik artinya dapat merusak kulit
5.
Jika dilarutkan ke dalam air menghasilkan ion
hidroksida (OH)
6.
Memiliki pH lebih dari 7. Semakin besar nilah pH
suatu zat maka semakin kuat derajat kebasaanya.
Teori Asam Basa
Dalam kehidupan sehari-hari, senyawa
asam dan basa memiliki peranan penting dalam kehidupan sehari-hari. Seperti
ditemukan dalam tubuh makhluk hidup, makanan, obat-obatan, produk rumah tangga,
pertanian maupun bahan baku industri. Berikut ini adalah gambar-gambar kegunaan
asam dan basa yang sering digunakan dalam kehidupan sehari-hari:
Berdasarkan gambar-gambar tersebut,
tahukah kalian apa pengertian dari senyawa asam-basa? Bagaimana cara
membedakannya?. Untuk mengetahuinya, kalian akan mempelajari pada bab ini.
Istilah asam (acid) berasal dari bahasa Latin “acetum” yang berarti cuka, karena diketahui zat utama dalam cuka adalah asam asetat. Adapun basa (alkali) berasal dari bahasa Arab yang berarti abu. Hingga saat ini, ada tiga pengertian asam-basa yang dikemukakan oleh empat ilmuwan. Mereka adalah Svante Arrhenius, Johannes Bronsted, Thomas Lowry, dan Gilbert Newton Lewis. Namun, pada pembahasan kali, hanya akan dibahas tentang teori asam-basa menurut Svante Arrhenius.
|
1 |
Teori
Asam-Basa Arrhenius |
Tahun 1884, ilmuwan Swedia bernama
Svante Arrhenius mengemukakan pengertian asam-basa berdasarkan reaksi ionisasi.
Menurut Arrhenius, asam adalah zat yang dalam air dapat melepaskan ion hidrogen
(H+), sedangkan basa adalah zat yang dalam air dapat melepaskan ion
hidroksida (OH-). Hal ini dapat dijelaskan dengan persamaan reaksi
ini:
|
2 |
Teori
Asam-Basa Bronsted Lowry |
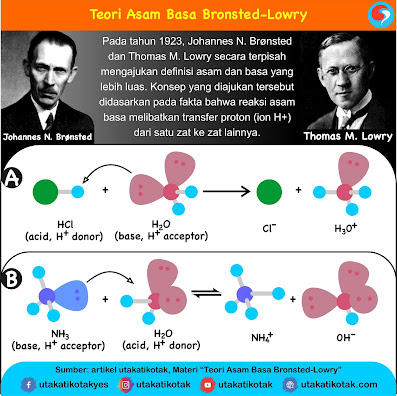
Teori Arrhenius ternyata hanya berlaku pada larutan dalam air. Teori ini tidak dapat menjelaskan fenomena pada reaksi tanpa pelarut atau dengan pelarut bukan air. Johannes Bronsted dan Thomas Lowry pada tahun 1923, menggunakan asumsi sederhana yaitu: Asam memberikan ion H+ pada ion atau molekul lainnya, yang bertindak sebagai basa. Contoh, disosiasi air, melibatkan pemindahan ion H+ dari molekul air yang satu dengan molekul air yang lainnya untuk membentuk ion H3O+ dan OH-.
Reaksi antara HCl dan air menjadi dasar untuk memahami definisi asam dan basa menurut Brønsted-Lowry. Menurut teori ini, ketika sebuah ion H+ ditransfer dari HCl ke molekul air, HCl tidak berdisosiasi dalam air membentuk ion H+ dan Cl-. Tetapi, ion H+ ditransfer dari HCl ke molekul air untuk membentuk ion H3O+, seperti berikut ini.
Sebagai sebuah proton, ion H+ memiliki ukuran yang lebih kecil dari atom yang terkecil, sehingga tertarik ke arah yang memiliki muatan negatif yang ada dalam larutan. Maka, H+ yang terbentuk dalam larutan encer, terikat pada molekul air. Model Brønsted, yang menyebutkan bahwa ion H+ ditransfer dari satu ion atau molekul ke yang lainnya, ini lebih masuk akal daripada teori Arrhenius yang menganggap bahwa ion H+ ada dalam larutan encer.
Dari pandangan model Brønsted, reaksi antara asam dan basa selalu melibatkan pemindahan ion H+ dari donor proton ke akseptor proton. Asam bisa merupakan molekul yang netral.
Pasangan asam-basa konjugasi
Reaksi antara asam dan basa Bronsted_Lowry disebut pertukaran proton. Jika asam disimbolkan sebagai HA dan basa disimbolkan sebagai B, maka reaksi umum asam-basa ini adalah:
Skema reaksi dapat dilihat pada persamaan berikut:Reaksi ke kanan, NH3
menerima proton dari H2O. Jadi, NH3 adalah basa dan H2O
adalah asam. Pada reaksi kebalikannya, NH4+ donor proton
terhadap OH–. Oleh sebab itu, ion NH4+ adalah
asam dan ion OH– adalah basa. Spesi NH3 dan NH4+
berbeda dalam hal jumlah protonnya. NH3 menjadi ion NH4+
melalui pengikatan proton, sedangkan ion NH4+ menjadi NH3
melalui pelepasan proton. Spesi NH4+ dan NH3
seperti ini dinamakan pasangan konjugat asam basa.
Pasangan konjugat asam basa terdiri atas dua spesi yang terlibat dalam reaksi asam basa, satu asam dan satu basa yang dibedakan oleh penerimaan dan pelepasan proton. Asam pada pasangan itu dinamakan asam konjugat dari basa, sedangkan basa adalah basa konjugat dari asam. Jadi, NH4+ adalah asam konjugat dari NH3 dan NH3 adalah basa konjugat dari NH4+.
Teori asam basa terus berkembang
dari waktu ke waktu. Pada tahun 1923, seorang ahli kimia Amerika Serikat,
Gilbert N. Lewis , mengemukakan teorinya tentang asam basa berdasarkan serah
terima pasangan elektron. Lewis berpendapat asam adalah partikel (ion atau
molekul) yang dapat menerima (akseptor) pasangan elektron. Sedangkan basa
didefinisikan sebagai partikel (ion atau molekul) yang memberi (donor) pasangan
elektron.
Reaksi asam basa menurut Lewis berkaitan dengan pasangan elektron yang terjadi pada ikatan kovalen koordinasi. Perhatikan reaksi di bawah ini.
Pada reaksi antara H+ dan NH3,
H+ bertindak sebagai asam, sedangkan NH3 bertindak
sebagai basa.
Teori asam basa Lewis
lebih luas daripada teori asam basa Arrhenius dan teori asam basa Bronsted-Lowry. Hal ini disebabkan:
- Teori Lewis dapat menjelaskan reaksi asam basa
dalam pelarut air, pelarut selain air, bahkan tanpa pelarut.
- Teori Lewis dapat menjelaskan reaksi asam basa
tanpa melibatkan transfer proton (H+), seperti reaksi antara NH3
dengan H+
Penentuan Sifat Asam Basa
Untuk dapat menentukan sifat asam basa dari suatu larutan kita dapat menggunakan suatu alat yang disebut dengan indikator. Indikator tersebut terdapat dalam berbagai macam bentuk dan wujud seperti kertas lakmus, indikator universal, Phenol Ptialin, Metilen biru dan lain sebagainya.
Indikator asam basa yang paling sederhana dan sering digunakan untuk menentukan sifat asam basa suatu larutan adalah kertas lakmus. Kertas lakmus terdapat dua jenis yakni lakmus merah dan lakmus biru. Apabila lakmus merah dimasukkan kedalam larutan asam maka warnanya tetap merah dan apabila dimasukkan kedalam larutan basa akan menjadi berwarna biru. Sedangkan apabila lakmus biru dimasukkan kedalam larutan asam maka akan berwarna merah dan pada larutan basa akan berwarna biru.
Untuk dapat memahaminya lebih lanjut simaklah video berikut.