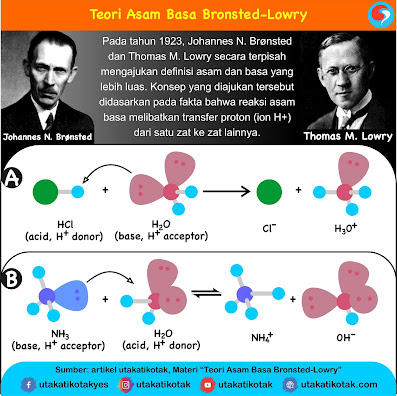
Halo sahabat PGP, setelah kita mengenal dilema etika dan bujukan moral dalam pengambilan suatu keputusan tentunya kita akan memiliki keresahan dan kegundahan jika dihadapkan pada kondisi dilema yang kompleks dalam pengambilan keputusan. Untuk dapat menentukan pilihan keputusan yang paling tepat, saya dihadapkan pada materi tentang konsep pengambilan dan pengujian keputusan. Ternyata, untuk menentukan keputusan terbaik yang sesuai dengan etika yang bersifat relatif terhadap situasi kondisi kita memerlukan pengujian sehingga keputusan yang kita ambil adalah keputusan yang terbaik untuk saat itu. Lalu seperti apa konsep tersebut? berikut saya kutip materi tentang Konsep pengambilan dan Pengujian Keputusan yang saya kutip dari Modul 3.1 PGP. Semoga bermanfaat.
Konsep Pengambilan dan Pengujian Keputusan
Untuk memandu kita dalam mengambil keputusan dan menguji keputusan yang akan diambil dalam situasi dilema etika ataupun bujukan moral yang membingungkan, ada 9 langkah yang dapat Anda lakukan. Anda dapat memilih salah satu dari kasus-kasus yang telah dibahas sebelumnya di modul ini untuk Anda gunakan sebagai contoh.
1. Mengenali nilai-nilai yang saling bertentangan
Mengapa langkah ini penting untuk Anda lakukan? Pertama, penting bagi kita untuk mengidentifikasi masalah yang sedang kita hadapi, alih-alih langsung mengambil keputusan tanpa menilainya dengan lebih saksama. Kedua, penting bagi kita untuk memastikan bahwa masalah yang kita hadapi memang betul-betul berhubungan dengan aspek moral, bukan sekedar masalah yang berhubungan dengan sopan santun dan norma sosial.
Tidak mudah untuk bisa mengenali hal ini. Kalau kita terlalu berlebihan, kita bisa terjebak dalam situasi seolah-olah kita terlalu mendewakan aspek moral, sehingga kita akan mempermasalahkan kesalahan-kesalahan kecil. Sebaliknya bila kita terlalu permisif, maka kita bisa menjadi apatis dan tidak bisa mengenali aspek-aspek permasalahan etika dalam masalah yang sedang kita hadapi.
2. Menentukan siapa yang terlibat dalam situasi ini.
Bila kita telah mengenali bahwa ada masalah moral di situasi yang sedang kita hadapi, pertanyaannya adalah dilema siapakah ini? Bukan berarti kalau permasalahan tersebut bukan dilema kita, maka kita menjadi tidak peduli. Karena kalau permasalahan ini sudah menyangkut aspek moral, kita semua seharusnya merasa terpanggil.
3. Kumpulkan fakta-fakta yang relevan dengan situasi ini.
Proses pengambilan keputusan yang baik membutuhkan data yang lengkap dan detail; apa yang terjadi di awal situasi tersebut, bagaimana hal itu terkuak, apa yang akhirnya terjadi, siapa berkata apa pada siapa, kapan mereka mengatakannya. Data-data tersebut penting karena dilema etika tidak bersifat teoritis, namun ada faktor-faktor pendorong dan penarik yang mempengaruhi situasi tersebut, sehingga data yang detail akan menjelaskan alasan seseorang melakukan sesuatu dan bisa juga mencerminkan kepribadian seseorang dalam situasi tersebut. Kita juga harus bisa menganalisis hal-hal apa saja yang potensial yang bisa terjadi di waktu yang akan datang.
4. Pengujian benar atau salah
1. Uji Legal
Pertanyaan penting di uji ini adalah apakah ada aspek pelanggaran hukum dalam situasi itu? Bila jawabannya adalah iya, maka situasi yang ada bukanlah antara benar lawan benar (dilema etika), namun antara benar lawan salah (bujukan moral). Keputusan yang harus diambil dalam situasi adalah pilihan antara mematuhi hukum atau tidak, dan keputusan ini bukan keputusan yang berhubungan dengan moral.
2. Uji Regulasi/Standar Profesional
Bila situasi yang dihadapi adalah dilema etika, dan tidak ada aspek pelanggaran hukum di dalamnya, mari kita uji, apakah ada pelanggaran peraturan atau kode etik di dalamnya. Konflik yang terjadi pada seorang wartawan yang harus melindungi sumber beritanya, seorang agen real estate yang tahu bahwa seorang calon pembeli potensial sebelumnya telah dihubungi oleh koleganya? Anda tidak bisa dihukum karena melanggar kode etik profesi Anda, tapi Anda akan kehilangan respek sehubungan dengan profesi Anda.
3. Uji Intuisi
Langkah ini mengandalkan tingkatan perasaan dan intuisi Anda dalam merasakan apakah ada yang salah dengan situasi ini. Apakah tindakan ini mengandung hal-hal yang akan membuat Anda merasa dicurigai. Uji intuisi ini akan mempertanyakan apakah tindakan ini sejalan atau berlawanan dengan nilai-nilai yang Anda yakini. Walaupun mungkin Anda tidak bisa dengan jelas dan langsung menunjuk permasalahannya ada di mana. Langkah ini, untuk banyak orang, sangat umum dan bisa diandalkan untuk melihat dilema etika yang melibatkan dua nilai yang sama-sama benar.
4. Uji Publikasi
Apa yang Anda akan rasakan bila keputusan ini dipublikasikan di media cetak maupun elektronik dan menjadi viral di media sosial. Sesuatu yang Anda anggap merupakan ranah pribadi Anda tiba-tiba menjadi konsumsi publik? Coba Anda bayangkan bila hal itu terjadi. Bila Anda merasa tidak nyaman kemungkinan besar Anda sedang menghadapi benar situasi benar lawan salah atau bujukan moral.
5. Uji Panutan/Idola
Dalam langkah ini, Anda akan membayangkan apa yang akan dilakukan oleh seseorang yang merupakan panutan Anda, misalnya ibu Anda. Tentunya di sini fokusnya bukanlah pada ibu Anda, namun keputusan apa yang kira-kira akan beliau ambil, karena beliau adalah orang yang menyayangi Anda dan orang yang sangat berarti bagi Anda.
Yang perlu dicatat dari kelima uji keputusan tadi, ada tiga uji yang sejalan dengan prinsip pengambilan keputusan yaitu:
Uji Intuisi berhubungan dengan berpikir berbasis peraturan (Rule-Based Thinking) yang tidak bertanya tentang konsekuensi tapi bertanya tentang prinsip-prinsip yang mendalam.
Uji publikasi, sebaliknya, berhubungan dengan berpikir berbasis hasil akhir (Ends-Based Thinking) yang mementingkan hasil akhir.
Uji Panutan/Idola berhubungan dengan prinsip berpikir berbasis rasa peduli (Care- Based Thinking), dimana ini berhubungan dengan golden rule yang meminta Anda meletakkan diri Anda pada posisi orang lain.
Bila situasi dilema etika yang Anda hadapi, gagal di salah satu uji keputusan tersebut atau bahkan lebih dari satu, maka sebaiknya jangan mengambil resiko membuat keputusan yang membahayakan atau merugikan diri Anda karena situasi yang Anda hadapi bukanlah situasi moral dilema, namun bujukan moral.
5.
Pengujian Paradigma Benar lawan Benar.
Dari keempat paradigma berikut ini, paradigma mana yang terjadi di situasi yang sedang Anda hadapi ini?
- Individu lawan masyarakat (individual vs community)
- Rasa keadilan
lawan rasa kasihan
(justice vs mercy)
- Kebenaran lawan kesetiaan (truth vs loyalty)
- Jangka pendek
lawan jangka panjang
(short term vs long term)
Pentingnya mengidentifikasi paradigma ini, bukan hanya mengelompokkan permasalahan, namun membawa penajaman bahwa situasi yang Anda hadapi betul- betul mempertentangkan antara dua nilai-nilai inti kebajikan yang sama-sama penting.
6. Melakukan Prinsip Resolusi
Dari 3 prinsip penyelesaian dilema, mana yang akan dipakai?
Berpikir Berbasis Hasil Akhir
(Ends-Based Thinking) Berpikir
Berbasis Peraturan (Rule-Based Thinking) Berpikir Berbasis
Rasa Peduli (Care-Based Thinking)
7. Investigasi Opsi Trilema
Dalam mengambil keputusan, seringkali ada 2 pilihan yang bisa kita pilih. Terkadang kita perlu mencari opsi di luar dari 2 pilihan yang sudah ada. Kita bisa bertanya pada diri kita, apakah ada cara untuk berkompromi dalam situasi ini. Terkadang akan muncul sebuah penyelesaian yang kreatif dan tidak terpikir sebelumnya yang bisa saja muncul di tengah-tengah kebingungan menyelesaikan masalah. Itulah yang dinamakan investigasi opsi trilema.
8. Buat Keputusan
Akhirnya kita akan sampai pada titik di mana kita harus membuat keputusan yang membutuhkan keberanian secara moral untuk melakukannya.
9. Lihat
lagi Keputusan dan Refleksikan
Ketika
keputusan sudah diambil. Lihat kembali proses pengambilan keputusan dan ambil pelajarannya untuk dijadikan acuan
bagi kasus-kasus selanjutnya.
Perlu kita ingat bahwa 9 langkah pengambilan keputusan ini adalah panduan, bukan sebuah metode yang kaku dalam penerapannya. Pengambilan keputusan ini juga merupakan keterampilan yang harus diasah agar semakin baik. Semakin sering kita berlatih menggunakannya, kita akan semakin terampil dalam pengambilan keputusan. Hal yang penting dalam pengambilan keputusan adalah sikap yang bertanggung jawab dan mendasarkan keputusan pada nilai-nilai kebajikan universal.