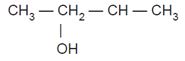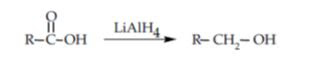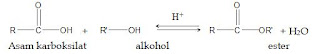A. GUGUS FUNGSI
Tabel
(Gugus Fungsi)
B.
HALOALKANA
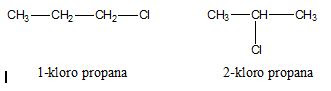
Haloalkana adalah senyawa karbon yang mengandung halogen. Haloalkana
memiliki rumus umum CnH2n+1X. X adalah atom
halogen (F, Cl, Br, I). Dengan kata lain, haloalkana adalah senyawa karbon
turunan alkana yang atom H-nya diganti oleh atom halogen.
Tata Nama Haloalkana
Isomer
Sifat Haloalkana
a. Sifat Fisika Haloalkana
Senyawa
haloalkana tidak membentuk ikatan hidrogen dan tidak larut dalam air. Sifat
fisika haloalkana lainnya yaitu haloalkana mempunyai titik didih dan titik
leleh lebih tinggi dari alkana yang mempunyai jumlah atom C yang sama. Hal ini
disebabkan adanya penggantian atom hidrogen dengan atom halogen yang mempunyai
massa atom lebih besar daripada hidrogen.
a. Sifat Kimia Haloalkana
1. Haloalkana mengalami reaksi substitusi
dengan suatu basa membentuk alkohol.
R – X + MOH → R – OH + MX
Contoh :
3. Haloalkana
bereaksi dengan logam natrium akan menghasilkan alkana. Reaksi ini disebut
Sintesis Wart.
4. Haloalkana
+ magnesium menghasilkan Pereaksi Grignard.
Jika larutan alkil dalam eter kering
dikocok dengan serbuk magnesium, maka akan terjadi pereaksi Grignard. Dari
sintesis inilah Victor Grignard pada tahun 1942 mendapat hadiah Nobel.
Kegunanaan dan dampak haloalkana
1.
Haloalkana sebagai zat anestesi
Kloroform (CHCl3) pernah digunakan secara luas
sebagai zat anestesi (pembius), tetapi kini sudah ditinggalkan. Kloroetana (C2H5Cl)
digunakan sebagai bahan anestesi lokal.
2.
Haloalkana sebagai antiseptik
Iodoform (CHI3) adalah suatu zat berwarna kuning,
berbau khas, dan digunakan sebagai antiseptik.
3.
Haloalkana sebagai pelarut
Tetraklorometana (CCl4) digunakan sebagai pelarut
untuk oli dan lemak serta dalam pencucian kering (dry cleaning).
4.
Haloalkana sebagai bahan pemadam api
Alkana terhalogenasi sempurna, seperti karbon tetraklorida
(CCl4), dan bromoklorodifluorometana (BCF) dapat memadamkan api.
5.
Senyawa klorofluorokarbon (CFC) dan freon
Freon merupakan nama dagang bagi suatu golongan senyawa
klorofluorokarbon (CFC) yang digunakan sebagai cairan pendingin (refrigerant)
atau sebagai propelan aerosol.
6.
Berbagai jenis senyawa haloalkena
Vinilklorida dan kloropena merupakan bahan dasar pada
industri plastik dan karet sintetis.
C.
ALKOHOL (R-OH)
Dalam kimia, alkohol
(atau alkanol) adalah istilah yang umum untuk senyawa organik apa pun yang
memiliki gugus hidroksil (-OH) yang terikat pada atom karbon. Alkohol mamiliki
rumus umum CnH2n+1OH
atau CnH2n+2O. Berdasarkan jenis atom C yang mengikat
gugus -OH, alkohol dibedakan atas alkohol primer, alkohol sekunder, dan alkohol
tersier.
1. Alkohol primer yaitu alkohol yang
gugus fungsinya (–OH) terikat pada atom C primer.
Contoh: CH3– CH2–OH
2. Alkohol sekunder, yaitu alkohol yang gugus fungsinya (–OH) terikat pada
atom C sekunder.
3. Alkohol tersier, yaitu alkohol yang gugus fungsinya
(–OH) terikat pada atom C
tersier.
Tata Nama
Alkohol
Ada dua cara pemberian nama pada alkohol, yaitu:
1. Penamaan secara trivial, yaitu dimulai dengan menyebut nama
gugus alkil yang terikat pada gugus –OH kemudian diikuti
kata alkohol. R - OH (
alkil-alkohol)
Contoh: CH3–CH2—OH Etil
alcohol
CH3–CH2–CH2–OH Propil
alcohol
2. Penamaan secara sistem IUPAC, yaitu dengan mengganti akhiran a pada
alkana dengan akhiran ol (alkana menjadi alkanol)
Contoh : CH3–CH2–OH Etanol
CH3–CH2–CH2–OH Propanol
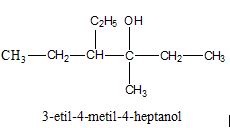
Urutan Penamaan Senyawa Alkohol menurut IUPAC
1. Menentukan rantai induk, yaitu rantai karbon terpanjang yang mengandung
gugus – OH, selain itu atom karbon lain sebagai cabang.
2. Memberi nomor pada rantai induk yang dimulai dari ujung rantai yang paling
dekat dengan gugus – OH.
3. Urutan penamaan:
a. nomor atom C yang mengikat cabang
b. nama cabang
c. nomor atom C yang mengikat gugus
d. nama rantai induk (alkanol)
4. Penulisan nama cabang sesuai urutan abjad.
5. Apabila posisi gugus –OH ekivalen dari kedua ujung rantai induk, maka
penomoran dimulai dari salah satu ujung sehingga cabang-cabang mendapat nomor
terkecil.
Isomer
1.
Keisomeran
Posisi
Keisomeran posisi, yaitu
keisomeran yang terjadi karena perbedaan letak gugus –OH dalam molekul alkohol.
2.
Keisomeran Optik
Keisomeran optik berkaitan dengan sifat optik, yaitu
kemampuan suatu senyawa untuk dapat memutar bidang cahaya
terpolarisasi.Keisomeran optik terjadi karena adanya atom C asimetrik, yaitu
atom C yang terikat pada 4 gugus yang berbeda.
3. Keisomeran Fungsi
Keisomeran fungsi, yaitu keisomeran yang terjadi karena perbedaan gugus fungsi di antara dua senyawa yang mempunyai rumus molekul sama. Alkohol berisomer fungsi dengan eter.
SIFAT ALKOHOL
Sifat alkohol
di kelompokkan menjadi 2 yaitu:
a) Sifat fisik
Alkohol
rantai pendek bersifat polar sehingga dengan baik larut dalam air
serta memiliki titik didih lebih tinggi dibandingkan dengan alkena. Dalam
hal kepolaran dan titik didih, alkohol rantai pendek memilki kemiripan sifat
dengan air. Hal tersebut disebabkan karena air dan alkohol keduanya memilki
gugus -OH. Gugus -OH ini bersifat polar sehingga menyebabkan air dan alkohol
bersifat polar pula. Adapun titik didih yang tinggi disebabkan oleh adanya
ikatan hidrogen antara molekul air, antar molekul alkohol atau antar molekul
air dan alkohol. Ikatan hidrogen ini juga menyebabkan alkohol larut dalam air.
b)Sifat kimia
1. Reaksi dengan Logam Natrium
- Alkohol sekunder teroksidasi membentuk keton.
Alkohol sekunder dioksidasi menjadi keton. Sebagai contoh, jika alkohol sekunder, propan-2-ol, dipanaskan dengan larutan natrium atau kalium dikromat(VI) yang diasamkan dengan asam sulfat encer, maka akan terbentuk propanon.
- Alkohol tersier sukar teroksidasi.
3.
Reaksi dengan
Hidrogen Halida
Jika alkohol direaksikan dengan hidrogen halida akan terbentuk
haloalkana dan air dengan reaksi:
R – OH + HX → R – X + H2O
Contoh:
CH3
– OH + HCl → CH3
– Cl + H2O
4.
Reaksi
esterifikasi
Reaksi
esterifikasi berlangsung lambat dan dapat balik (reversibel).
Persamaan untuk reaksi antara sebuah asam RCOOH dengan sebuah alkohol R’OH.
5.
Reaksi Dehidrasi
Alkohol
Alkohol
jika dipanaskan dengan asam kuat, maka akan terjadi alkena dan
air.
Kegunaan Alkohol
Dalam kehidupan sehari-hari alkohol
banyak digunakan, antara lain sebagai berikut.
1)
Dalam bidang
farmasi (obat-obatan), sebagai pelarut senyawa organik,misalnya etanol
dan butanol.
2)
Dalam bidang
biologi atau industri digunakan sebagai
disinfektan, misalnya etanol dan metanol
3)
Sebagai bahan
bakar, misalnya spiritus (campuran antara methanol dan etanol).
D. ETER
(R-O-R’)
Eter atau alkoksi alkana merupakan turunan alkana yang mempunyai struktur berbeda dengan alkohol. Eter mempunyai rumus umum R–O–R’ . Dengan gugus fungsi –O– yang terikat pada dua gugus alkil. Gugus alkil yang terikat dapat sama dan dapat berbeda.
Tata Nama
Ada dua cara
pemberian nama eter, yaitu:
1. Penamaan secara trivial dimulai dengan menyebut nama alkil yang
terikat pada gugus –O– kemudian diikuti oleh kata eter.
2. Penamaan berdasarkan IUPAC, yaitu penataan
nama senyawa eter dimulai dengan nama gugus alkoksi diikuti oleh nama rantai
utamanya. Gugus alkoksi dianggap sebagai cabang yang terikat pada rantai induk.
Contoh:
Eter memilki dua isomer, yaitu isomer struktur dan
isomer fungsional.
1) Isomer Struktur
Isomer struktur ialah senyawa yang memiliki rumus molekul sama, namun rumus
strukturnya berbeda. Contohnya dietil eter memiliki isomer struktur dengan metil
propil eter dan metil isopropil eter.
2) Isomer Fungsional
Alkohol dan eter keduanya memiliki rumus umum yang sama, Akan tetapi,
keduanya memiliki jenis gugus fungsional yang berbeda. Dua senyawa yang
memiliki rumus umum molekul sama namun gugus fungsionalnya berbeda disebut
memiliki keisomeran fungsional. Eter berisomer fungsional dengan alkohol.
Isomer
Eter memilki dua isomer, yaitu isomer struktur dan
isomer fungsional.
1) Isomer Struktur
Isomer struktur ialah senyawa yang memiliki rumus molekul sama, namun rumus
strukturnya berbeda. Contohnya dietil eter memiliki isomer struktur dengan metil
propil eter dan metil isopropil eter.
2) Isomer Fungsional
Alkohol dan eter keduanya memiliki rumus umum yang sama, Akan tetapi,
keduanya memiliki jenis gugus fungsional yang berbeda. Dua senyawa yang
memiliki rumus umum molekul sama namun gugus fungsionalnya berbeda disebut
memiliki keisomeran fungsional. Eter berisomer fungsional dengan alkohol.
SIFAT-SIFAT ETER
Sifat-sifat
eter yaitu pada keadaan standar, hampir seluruh senyawa eter berwujud cair,
kecuali dimetil eter (gas). Jika dibandingkan dengan senyawa alkohol, titik
didih dan titik leleh eter lebih keci. Ini terjadi karena antar molekul eter
tidak membentuk ikatan hidrogen. Eter juga cenderung bersifat nono polar,
sehingga kelarutannya dalam air sangat kecil. Selain itu eter bersifat mudah
terbakar. Dibandingkan terhadap alkohol, eter jauh kurang reaktif kecuali dalam
hal pembakaran.Eter jauh lebih mantap (lebih kurang reaktif) dibandingkan
alkohol. Eter tidak bereaksi dengan logam natrium. Sifat ini dapat digunakan
untuk membedakan alkohol dengan eter.
Adapun reaksi-reaksi eter yaitu:
d. Reaksi dengan asam-asam mineral
Walaupun eter tahan terhadap
hidrolisis, ia dapat dibelah oleh asam-asam mineral seperi asam bromat dan asam
iodat. Asam klorida hanya membelah eter dengan sangat
lambat. Metil eter umumnya akan menghasilkan metil halida:
ROCH3 + HBr
→
CH3Br + ROH
Reaksi ini berjalan via zat
antara onium, yaitu [RO(H)CH3]+Br–. Beberapa jenis eter dapat terbelah dengan cepat
menggunakan boron
tribomida (dalam beberapa kasus aluminium klorida juga dapat digunakan) dan
menghasilkan alkil bromida.Berganting pada substituennya, beberapa eter dapat
dibelah menggunakan berbagai jenis reagen seperti basa kuat.
Kegunaan dan Dampak Eter dalam Kehidupan
a. Kegunaan
1) Eter digunakan sebagai pelarut.
2) Dietil eter digunakan sebagai obat bius pada
operasi.
3) Metil ters-butil eter (MTBE) digunakan untuk
menaikkan angka oktan bensin.
b. Dampak
Pada konsentrasi rendah, eter dapat menyebabkan pusing kepala,
sedangkan pada konsentrasi tinggi menyebabkan tidak sadarkan diri.
E. ALKANAL/ALDEHID
Aldehid atau alkanal adalah senyawa
turunan alkana dengan gugus fungsi COH, dengan rumus molekul CnH2nO. Aldehid mempunyai rumus struktur sebagai
berikut:
Tata Nama Senyawa Aldehida
Tata nama
senyawa aldehida dijelaskan dalam dua aturan yakni aturan tata nama IUPAC dan
trivial.
a.
Nama IUPAC
Nama aldehid sebagai turunan dari alkana diturunkan dari nama alkana
dengan mengganti akhiran a dengan al.
Contoh:
Tata nama senyawa aldehid dengan rantai cabang sama seperti tata nama alkohol, tetapi posisi gugus fungsi –CHO tidak perlu dinyatakan karena selalu menjadi atom karbon nomor satu.
b.
Nama
Trivial
Isomer Aldehid
Aldehid tidak mempunyai isomer posisi karena gugus fungsi
dari aldehid terletak di ujung rantai C. Isomer pada aldehid terjadi karena
adanya cabang dan letak cabang, jadi aldehid memiliki isomer struktur.
Pembuatan
Aldehid
Aldehida dibuat dengan cara oksidasi
alkohol primer dengan menggunakan oksidator KMnO4 atau K2Cr2O7
dalam skala laboratorium. Berikut persamaan reaksi :
Untuk skala industri aldehida dibuat
dari uap alkohol yang direaksikan dengan udara dan dikatalisis oleh tembaga
atau perak. Contohnya metanal dapat dibuat dengan mereaksikan uap metanol
dengan udara. Persamaan reaksi :

Sifat-sifat
Aldehid
Perhatikan data pada tabel titik didih dan titik lebur berikut.
a. Sifat
fisik aldehida
· Pada
suhu ruang senyawa aldehida yang memiliki jumlah atom C sebanyak 1 dan 2
berfasa gas. senyawa aldehida dan keton dengan jumlah atom C lebih dari sama
dengan 3 berfasa cair
· Aldehida suku rendah
berupa zat cair yang berbau tidak enak
· Aldehida
suku tinggi
berupa zat cair kental dan berbau enak
· Senyawa aldehida dengan C atom rendah (1-5 atom C)
larut dalam air
· Senyawa aldehida dengan jumlah atom C lebih besar dari
5 sukar larut dalam air
c.
Sifat
Kimia aldehida
Reaksi Oksidasi
Senyawa aldehid direaksikan dengan oksidator, maka akan merbentuk asam karboksilat. Oksidator yang digunakan adalah KMnO4, K2Cr2O7, larutan Fehling, dan larutan Tollens.
1. Reaksi aldehida dengan KMnO4 atau K2Cr2O7
2.
Reaksi
dengan larutan Fehling
Pereaksi Fehling adalah
campuran CuSO4(aq) dengan kalium
natrium tartrat dalam suasana basa. Pereaksi Fehling dapat dianggap CuO. Reaksi
aldehid dengan larutan Fehling menghasilkan endapan merah bata dari Cu2O.
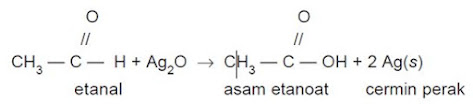
3. Reaksi dengan larutan Tollens
Pereaksi Tollens adalah
larutan AgNO3 dalam larutan NH3 berlebih. Pereaksi Tollens dapat dianggap
sebagai larutan Ag2O. Reaksi aldehid dengan larutan Tollens akan menghasilkan
endapan perak. Endapan perak yang dihasilkan akan melapisi tabung membentuk
cermin. Oleh karena itu, reaksi ini disebut reaksi cermin perak.
Reaksi Aldehid
Reaksi yang mengubah senyawa karbon tidak jenuh (mempunyai ikatan
rangkap) menjadi senyawa karbon jenuh (tidak mempunyai ikatan rangkap)
dinamakan reaksi adisi. Karena aldehid memiliki ikatan rangkap antara C dengan
O, maka aldehid dapat diadisi.
Contoh:
F. KETON
Tata
Nama Keton
Nama IUPAC
Nama IUPAC dari keton adalah alkanon. Suku terendah dari alkanon adalah
propanon. Untuk alkanon yang mempunyai isomer pemberian nama senyawa sebagai
berikut.
a. Rantai pokok adalah rantai terpanjang yang mengandung gugus fungsi — C —
diberi nama alkanon ||
O
b. Penomoran dimulai dari C ujung yang terdekat dengan posisi gugus fungsi
sehingga C yang mengandung gugus fungsi mendapat nomor terkecil.
c. Pemberian nama sama seperti alkanol. Cabang-cabang disebut lebih dulu,
disusun menurut abjad dan diberi awalan yang menyatakan jumlah cabang tersebut.
Letak gugus fungsi dinyatakan dengan awalan angka pada nama rantai pokok.
Contoh :
Nama Trivial
Menyebut dulu gugus alkil yang terikat pada
atom C gugus karbonil kemudian diikuti kata keton. Penyebutan gugus alkil
mengikuti urutan abjad.
Contoh:
Isomer
Keton
Keton dapat memiliki isomer kerangka,
posisi, maupun fungsi
1)
Isomer
kerangka
Molekul C6H12O
dapat berbentuk:
2)
Isomer
Posisi
Molekul C5H10O
dapat berbentuk:
3)
Isomer
Fungsi
Molekul C4H8O
dapat berbentuk:
Pembuatan
Keton
Senyawa keton dapat dibuat dengan
beberapa cara, yaitu:
1) Oksidasi alkohol sekunder dengan suatu oksidator, misalnya; K2Cr2O7
2)
Oksidasi Oppenauer, yaitu dengan cara penggodokan alkohol
sekunder dengan aluminium t-butoksida dan aseton yang berlebihan menghasilkan
dehidrogenasi alkohol
3) Pirolisis
dari garam logam. Jika kalsium asetat dipanaskan dengan kuat akan mengalami
penguraian menjadi aseton dan kalsium karbonat.
Sifat
Fisik dan Sifat kimia Keton
Perhatikan data pada tabel
titik didih dan titik lebur berikut.
a.
Sifat
fisik keton
· Berupa zat cair
yang tidak berwarna dan berbau menyengat pada suku rendah
· Mudah larut
dalam air pada suku rendah
· Berupa zat
padat pada suku tinggi
· Memiliki titik didih yang relatif tinggi
b.
Sifat Kimia Keton
Reaksi-reaksi Keton
Keton memiliki
ikatan rangkap antara C dengan O, maka aldehid dapat diadisi.
1.
Adisi
aldehid oleh hidrogen
Menghasilkan alkohol sekunder, reaksi ini merupakan
reaksi reduksi.
2.
Adisi
aldehid oleh HCN
3.
Adisi
aldehid oleh NaHSO3
G. Asam Alkanoat / Asam Karboksilat
Buah jeruk mengandung asam sitrat
yang merupakan contoh dari asam alkanoat. Asam alkanoat tergolong asam organik
alifatik yang memiliki gugus fungsional –COOH yang disebut sebagai gugus
karboksil. Asam alkanoat disebut juga asam karboksilat.
Melalui bahan ajar ini Anda akan mengetahui lebih dalam
lagi apa itu asam alkanoat , bagaimana struktur,
tatanama, sifat fisika, sifat kimia, kegunaan serta hal-hal penting lainnya terkait asam alkanoat yang sangat penting kalian ketahui.
Struktur Asam Alkanoat
Asam alkanoat yang disebut juga asam karboksilat
merupakan senyawa karbon yang memiliki gugus fungsi karboksil (– COOH ) dengan
rumus molekul CnH2nO2
dengan n = 2, 3, 4 dst. Asam karboksilat
mempunyai rumus struktur rumus struktur sebagai berikut:
Berikut
ini beberapa contoh asam karboksilat :
Tatanama Senyawa Asam Karboksilat
1. Tatanama IUPAC
Nama asam alkanoat menurut aturan
IUPAC sesuai penamaan alkana yaitu dengan menambahkan awalan asam diikuti
nomor-nomor dan nama cabang kemudian akhiran a pada alkana diganti dengan oat.
Untuk senyawa yang mempunyai isomer, cara penamaannya adalah sebagai berikut :
1)
Rantai pokok adalah rantai
terpanjang yang mengandung gugus fungsi –COOH
2)
Penomoran dimulai dari
gugus –COOH
3) Penulisan nama dimulai
dengan nama cabang atau gugus lain yang disusun menurut abjad kemudian nama
rantai pokok. Posisi gugus fungsi tidak perlu disebutkan karena selalu menjadi
atom karbon nomor satu.
2. Nama TRIVIAL
Nama lazim asam
karboksilat didasarkan pada sumber alami asam yang bersangkutan. Misalnya, asam
butanoat disebut asam butirat karena terdapat dalam mentega.
Contoh:
Jika menggunakan
nama trivial, maka posisi gugus-gugus pengganti atau cabang-cabang dinyatakan
dengan huruf latin. Atom karbon yang terikat langsung pada gugus –COOH , yang merupakan atom C nomor 2
ditandai dengan alfa(α), atom C nomor 3 dengan beta (β), atom C nomor 4 dengan
gamma (γ), dan seterusnya.
ISOMER
Asam karboksilat
memiliki dua macam isomeri, yaitu:
1)
Isomer
rangka
Isomer rantai
pada asam karboksilat dimulai pada asam karboksilat dengan jumlah atom karbon
tiga.
2)
Isomer
Fungsi
Ester dan asam
karboksilat merupakan isomer fungsi karena keduanya memiliki rumus molekul yang
sama, contoh:
PEMBUATAN
Asam karboksilat dapat dibuat dengan beberapa cara, yaitu:
1) Oksidasi alkohol primer atau aldehida dengan suatu oksidator.
Oksidator yang biasa digunakan K2Cr2O7 dan
KMnO4
2)
Dengan mereaksikan gas CO2 dengan pereaksi Grignard
3)
Hidrolisis senyawa alkana nitril pada suhu tinggi dan asam kuat
4) Asam
formiat dibuat dengan mereaksikan gas CO dengan uap air, dengan katalisator
oksida logam pada suhu sekitar 200oC dan tekanan tinggi.
Beberapa sifat
asam karboksialat adalah:
1) Dapat membentuk ikatan hidrogen dengan air sehingga pada umumnya
mempunyai titik didih tinggi daripada ester. Dalam fase uap dan sebagai
pelarut, asam karboksilat membetuk dimer. Dimer terurai membentuk monomer,
selanjutnya membentuk ikatan hydrogen dengan molekul air
2) Mulai dari C1 sampai dengan C4 mudah larut dalam air. Makin
panjang rantai C-nya makin sukar larut dalam air. Gugus karboksil dalam asam
karboksilat adalah polar dan dengan mudah membentuk ikatan hydrogen dengan
molekul air. Pada umumnya asam karboksilat larut dalam pelarut organic seperti
etanol atau aseton.
3) Adanya cabang akan mempengaruhi derajat
keasaman. Cabang alkil akan mengurangi keasaman, sedangkan jika cabangnya
atom-atom halogen akan menambah keasaman.
Semua asam karboksilat merupakan asam lemah yang dalam pelarut air, sebagian
molekulnya terionisasi menghasilkan H+.
SIFAT KIMIA
1)
Asam
karboksilat bereaksi dengan basa
membentuk garam (Penetralan)
2) Asama karboksilat bereaksi dengan alkohol membentuk ester (esterifikasi)
3)
Reduksi
asam karboksilat menghasilkan alkohol primer
4)
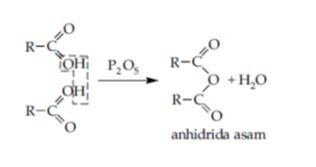
Pembentukan
anhidrida asam karboksilat
KEGUNAAN
Asam karboksilat banyak
dipergunakan dalam kehidupan sehari -hari, di antaranya adalah:
1) Asam formiat (asam semut) banyak digunakan dalam industri
tekstil, penyamakan kulit, dan di perkebunan karet untuk menggumpalkan lateks
(getah pohon karet).
2)
Asam asetat (asam cuka) sebagai pemberi rasa asam dan sebagai
pengawet makanan.
3) Asam sitrat digunakan pad industri pengolahan makanan, kosmetik,
farmasi dan pengolahan resin
4)
Sebagai bahan pembuatan ester dengan cara mereaksikannya dengan
alkohol.
5) Asam karboksilat suku tinggi dipergunakan untuk pembuatan sabun
jika direaksikan dengan basa, misalnya asam stearat, asam palmitat, dan
lain-lain.
Dalam kehidupan sehari-hari
kita sering mengkonsumsi berbagai macam minuman rasa buah yang mungkin
kebanyakan tidak benar-benar berasal dari buah asli tetapi hanya dicampuri essens
(aroma buah). Essens terbuat dari senyawa alkil alkanoat yang aromanya bermacam-macam
tergantung alkil alkanoat penyusunnya. Alkil alkanoat sering dikenal dengan
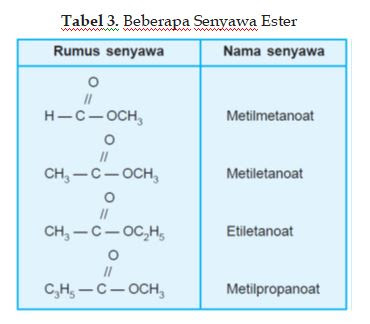
nama ester. Beberapa ester dan aroma karakteristiknya sebagaimana tercantum
pada tabel di bawah ini.
Senyawa di atas dinamakan butil butanoat yang dapat memberi rasa nanas. Gugus karboksil pada ester terikat pada dua atom karbon, sedangkan pada asam karboksilat terikat pada atom karbon dan hidrogen. Jadi, senyawa ester adalah turunan alkana yang memiliki gugus karboksil terikat pada dua alkil. Atom karbon pada gugus karboksil ester mengikat dua atom oksigen, berbeda dengan gugus karbonil pada aldehida dan keton yang hanya mengikat satu atom oksigen.
Penamaan ester hampir sama dengan asam karboksilat, hanya saja karena atom H dari gugus –OH diganti dengan gugus alkil, maka nama asam diganti dengan nama alkil dari R . Sehingga berdasarkan IUPAC ester mempunyai nama alkil alkanoat.
Perhatikan contoh berikut ini:
nama alkilnya (lingkaran elips) disebutkan lebih dahulu yaitu propil. Rantai induk alkanoat (garis persegi) memiliki dua atom C sehingga disebut etanoat. Nama senyawa di atas adalah propil etanoat.
b.
Jawab:
Disebutkan nama alkilnya (lingkaran
elips) terlebih dahulu yaitu isobutil. Rantai induk alkanoat (garis
persegi)memiliki empat atom C dan satu cabang metil pada C2 sehingga disebut
2-metilbutanoat. Nama senyawa di atas adalah isobutil-2-metilbutanoat.
ISOMER
Ester memiliki
dua macam isomeri, yaitu:
1)
Isomer
Struktur
Isomer struktur
pada ester dimulai pada ester dengan jumlah atom karbon tiga.
2)
Isomer
Fungsi
Ester dan asam
karboksilat merupakan isomer fungsi karena keduanya memiliki rumus molekul yang
sama, contoh:
PEMBUATAN
Ester dapat
dibuat dengan beberapa cara, yaitu:
a. Reaksi
esterifikasi adalah reaksi pembentukan senyawa ester secara langsung dari suatu
asam karboksilat dan alkohol. Reaksi esterifikasi dapat dituliskan sebagai
berikut ini:
b.
Mereaksikan
perak karboksilat dengan alkil halida
c.
Mereaksikan
anhidrida asam alkanoat dengan alkohol.
d.
Mereaksikan
halogen asam alkanoat dengan alkohol.
Beberapa sifat ester adalah:
1) Ester mudah menguap dibandingkan dengan asam atau alkohol pembentuknya karena tidak memiliki gugus –OH yang bebas.
2) Ester berbau harum dan banyak terdapat pada buah-buahan.
3) Ester sedikit larut dalam air.
4) Titik didih dan titik beku ester lebih rendah daripada asam karboksilat
1. Sifat
Kimia (reaksi-reaksi)
1)
Ester
mudah direduksi oleh gas hidrogen menjadi alkohol.
2) Ester
mudah terhidrolisis oleh air dalam suasana asam menjadi asam karboksilat dan
alkohol. Reaksi ini merupakan kebalikan dari reaksi esterifikasi. Reaksi umum
hidrolisis ester adalah sebagai berikut:
3) Ester
mudah terhidrolisis oleh basa kuat menjadi garam karboksilat dan alkohol. Reasi
ini disebut juga dengan reaksi saponifikasi atau penyabunan
berlangsung secara ireversibel. Reaksi umum hidrolisis basa ester sebagai berikut:
1)
Ester
dengan alkil pendek banyak ditemukan dalam buah-buahan dan menimbulkan aroma
khas buah-buahan tersebut. meskipun rasa dan bau dari buah merupakan campuran
kompleks dari berbagai senyawa, dengan menggunakan beberapa campuran senyawa
ester maka hasilnya cukup mirip aroma buah aslinya. Oleh sebab itu, senyawa
ester banyak disintesis dan digunakan sebagai esens dan parfum.
2) Digunakan
sebagai pelarut lem, mislanya senyawa etil etanoat yang mudah menguap dan
meninggalkan lem melekat pada permukaan.
3) Dibuat
sebagai bahan baku serat sintetis polyester,
yaitu dakron. Tekadang serat sintetis ini dicampurkan dengan serat alami untuk
memperkuat kain. Ester juga digunakan sebagai pelentur dalam PVC sehingga
plastik lebih fleksibel namun tetap kuat.
4) Ester
rantai panjang berupa minyak dan lemak, dapat digunakan sebagai bahan baku
sabun, mentega, dan malam mainan. Mentega dan margarin dihasilkan dari reaksi
hidrogenasi minyak/lemak dengan katalis Ni sehingga padat. Malam yang disebut
juga lilin (wax) merupakan campuran
dari dua senyawa ester atau lebih, biasanya digunakan sebagai mainan anak-anak
karena mudah dibentuk dan lunak. Apabila dilarutkan dalam pelarut organik,
malam dapat digunakan untuk pemoles mobil dan lantai.