A. Satuan Konsentrasi Larutan
Marilah kita pelajari kembali mengenai konsentrasi larutan sebelum kita mempelajari sifat koligatif larutan. Satuan konsentrasi ada beberapa macam, antara lain adalah molalitas (m), molaritas (M), dan fraksi mol (x).
1. Molalitas
(m)
Apakah yang kamu ketahui tentang molalitas? Molalitas merupakan
satuan konsentrasi yang penting untuk menentukan sifat-sifat yang tergabung dari
jumlah partikel dalam larutan.
Molalitas didefinisikan sebagai banyak
mol
zat terlarut yang dilarutkan
dalam satu kilogram (1.000 gram)
pelarut. Misalkan jika 2 mol garam dapur
(NaCl) dilarutkan dalam 1.000 gram
air maka molalitas garam dapur tersebut adalah 2 molal.
Secara matematis pernyataan
tersebut dinyatakan seperti berikut.
Keterangan:
m = molalitas larutan
n = jumlah mol zat terlarut
p = massa pelarut (gram)
Jumlah mol zat terlarut
(n) dapat kita tentukan
dari
massa zat terlarut (m)
dibagi dengan massa molekul relatif
zat terlarut
(Mr). Jadi
persamaan (1.1) dapat juga
kita tuliskan seperti berikut.
3. Fraksi Mol (x)
Fraksi mol (x) menyatakan
perbandingan mol salah satu komponen
dengan jumlah mol semua komponen-
komponen. Perhatikan contoh berikut. Misalkan 2 mol garam (NaCl) yang dinotasikan dengan A dilarutkan
dalam 8 mol air yang dinotasikan dengan B, maka fraksi
mol garam
(xA) = 0,2
dan fraksi mol air (xB) = 0,8.
Perhatikan gambar di bawah!
Jadi, fraksi mol masing-masing komponen dalam suatu larutan dapat ditentukan sebagai berikut.
Pada saat kamu memasak air, apa yang terjadi jika air tersebut mendidih kamu tambahkan gula? Air yang semula mendidih akan berhenti beberapa saat ketika kamu tambahkan gula, kemudian akan mendidih kembali. Hal ini menunjukkan bahwa telah terjadi kenaikan titik didih. Titik didih air murni lebih rendah daripada titik didih larutan gula. Kenaikan titik didih ini bergantung jumlah zat terlarut yang ditambahkan pada pelarut, dalam contoh ini bergantung jumlah gula yang ditambahkan pada air. Sifat inilah disebut sifat koligatif larutan.
Sifat koligatif larutan yang lain
adalah penurunan tekanan uap, penurunan
titik beku, dan tekanan osmotik.
Jadi sifat
koligatif larutan
tergantung pada konsentrasi zat terlarut dan tidak
dipengaruhi oleh jenis
zat terlarut. Agar lebih jelas,
marilah kita pelajari uraian dari masing-masing sifat koligatif larutan.
1.
Penurunan Tekanan
Uap Jenuh
Pernahkah kamu melihat peristiwa penguapan? Pada peristiwa
penguapan terjadi perubahan
dari zat cair menjadi gas. Jika zat cair dimasukkan
ke dalam suatu ruangan tertutup maka zat tersebut
akan menguap hingga ruangan tersebut jenuh. Pada keadaan ini proses penguapan
tetap berlangsung dan pada saat yang sama juga terjadi proses pengembunan. Laju penguapan
sama dengan laju pengembunan. Keadaan ini dikatakan terjadi
kesetimbangan dinamis antara zat cair dan uap jenuhnya.
Artinya bahwa tidak akan terjadi perubahan lebih lanjut tetapi
reaksi atau proses yang terjadi masih terus berlangsung. Tekanan yang disebabkan
oleh uap jenuh dinamakan tekanan
uap jenuh. Besarnya
tekanan uap jenuh dipengaruhi oleh jumlah zat dan suhu. Makin besar tekanan uap suatu cairan, makin mudah molekul-molekul cairan itu berubah menjadi uap. Tekanan uap suatu larutan dapat diukur dengan alat manometer
merkurium. Perhatikan gambar 2.1.
Pada alat tersebut
setelah larutan dimasukkan dalam labu, semua
udara dalam pipa
penghubung dikeluarkan melalui pompa vakum. Jika
keran ditutup, maka uap yang
ada dalam pipa penghubung hanyalah uap dari pelarut
larutan tadi sehingga uap itu
disebut tekanan uap larutan tersebut.
Semakin tinggi suhu cairan semakin
banyak uap yang berada di atas permukaan cairan dan tekanan uap yang terbaca semakin tinggi.
Untuk mengetahui penurunan tekanan uap maka pada tahun 1880-an kimiawan Perancis F.M. Raoult mendapati bahwa
melarutkan suatu zat terlarut mempunyai efek penurunan
tekanan uap dari pelarut.
Apabila pada pelarut murni kita
tambahkan sejumlah zat terlarut yang
tidak mudah menguap, apa yang
akan terjadi? Coba perhatikan gambar berikut ini.
Dalam
larutan, terjadi interaksi antara zat terlarut dengan pelarut sehingga zat
terlarut tersebut akan menghalangi pelarut untuk menguap. Hal ini menyebabkan
tekanan uap larutan lebih kecil daripada pelarut murni. Inilah yang dinamakan
penurunan tekanan uap jenuh. Selisih antara tekanan uap murni dengan tekanan
uap larutan jenuh dapat dituliskan secara matematis seperti berikut.
Persamaan
(2.2) di atas dikenal dengan hukum Raoult. Hukum
Raoult hanya berlaku pada
larutan ideal dan larutan tersebut
merupakan larutan encer tetapi
pada larutan encer yang tidak
mempunyai interaksi
kimia di antara komponen-komponennya,
hukum Raoult berlaku pada pelarut saja.
Adapun banyaknya penurunan tekanan uap ( ΔP
) sama dengan hasil kali fraksi mol terlarut
(xA) dan
tekanan uap pelarut murni (P0). Pernyataan ini secara matematis dapat
dituliskan seperti berikut.
2.
Kenaikan Titik Didih (ΔTb )
Mengapa air mendidih pada suhu 100 oC?
Pada pembahasan terdahulu telah disebutkan bahwa air dapat menguap pada suhu
berapa saja dan tekanan uapnya akan meningkat seiring dengan kenaikan suhu. Tekanan
uap menggambarkan kecenderungan cairan untuk menguap. Semakin besar tekanan
uap, semakin mudah zat itu menguap. Sementara itu, tekanan udara luar memaksa
uap tetap berada dalam cairan. Jika tekanan uap kurang dari tekanan udara luar
(tekanan dipermukaan cairan), uap hanya terbentuk dari permukaan cairan. Namun
ketika tekanan uap cairan sama dengan tekanan udara dipermukaan, penguapan
dapat terjadi di seluruh bagian cairan. Uap yang terbentuk dapat naik dan pecah
dipermukaan. Keadaan seperti itu disebut mendidih.
Jadi, titik didih adalah suhu pada saat tekanan uap cairan sama
dengan tekanan dipermukaan. Oleh karena
itu, titik didih bergantung pada tekanan dipermukaan. Dipermukaan laut (tekanan
= 760 mmHg), air mendidih pada 100oC karena pada suhu 100oC
tekanan uap air sama dengan 760 mmHg. Di pencak Everest (ketinggian 8.882 m
dari permukaan laut), air mendidih pada 71oC. Biasanya, yang
dimaksud dengan titik didih adalah titik didih normal, yaitu titik didih pada tekanan
760 mmHg. Titik didih normal air adalah 100oC.
Telah dijelaskan sebelumnya bahwa tekanan uap larutan lebih rendah
daripada tekanan uap pelarutnya. Hal ini disebabkan karena zat terlarut itu
mengurangi bagian atau fraksi dari pelarut sehingga kecepatan penguapan
berkurang.
Hubungan antara tekanan uap jenuh dan suhu air dalam larutan
berair ditunjukkan pada gambar dibawah ini.
Garis mendidih air digambarkan oleh garis CD, sedangkan garis
mendidih larutan digambarkan oleh garis BG. Titik didih larutan dinyatakan
dengan Tb1, dan titik didih pelarut dinyatakan dengan Tb0.
Larutan mendidih pada tekanan 1 atm. Dari gambar diatas dapat dilihat bahwa
titik didih larutan (titik G) lebih tinggi dari pada titik didih air (titik D).
Jika sama-sama mendidih, manakah yang lebih tinggi suhunya, air
murni atau air laut? Melalui percobaan telah kita
ketahui bahwa larutan dari zat-zat yang sukar menguap mempunyai titik didih
lebih tinggi dari pada pelarutnya. Sebagai contoh larutan garam mendidih pada
suhu di atas 100oC.
Selisih antara titik didih larutan dengan titik didih pelarutnya disebut kenaikan titik didih (∆Tb = boilling point elevation).
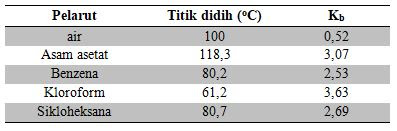
Harga Kb bergantung pada jenis pelarut. Harga Kb
beberapa pelarut diberikan pada tabel 2.1.
Tabel 2.1 Tetapan kenaikan titik didih molal (Kb) dari beberapa
pelarut
3. Penurunan Titik Beku
(∆Tf)
Titik beku adalah suhu pada saat tekanan uap
cairan sama dengan tekanan uap padatannya. Pada tekanan 1 atm, air membeku pada
0oC karena pada suhu itu tekanan uap air sama dengan tekanan uap es.
Penurunan titik beku pada konsepnya sama dengan
kenaikan titik didih. Larutan mempunyai titik beku yang lebih rendah dibandingkan
dengan pelarut murni. Selisih antara titik beku larutan dengan titik beku
pelarut disebut penurunan titik beku (∆Tf = freezing point deppression).
Harga Kf
bergantung pada jenis pelarut. Harga Kf
dari beberapa pelarut diberikan pada tabel 2.2.
Tabel 2.2 Tetapan penurunan titik beku molal (Kf) dari beberapa pelarut
4. Tekanan Osmosis
Larutan (∏)
Osmosis adalah
peristiwa mengalirnya molekul-molekul pelarut ke dalam larutan secara spontan
melalui selaput semipermeable, atau peristiwa mengalirnya molekul-molekul zat
pelarut dari larutan yang lebih encer ke larutan yang lebih pekat. Proses
osmosis terdapat kecenderungan untuk menyetimbangkan konsentrasi antara dua
larutan yang saling berhubungan melalui membran.
Perhatikan peristiwa osmosis pada gambar 2.3. gabar tersebut menunjukkan osmometer yang diisi larutan gula, kemudian dimasukkan ke dalam gelas kimia yang berisi air, ternyata permukaan larutan gula pada osmoter naik. Akan tetapi jika di atas torak diberi beban tertentu (Gambar 2.4), maka aliran air ke dalam osmoter dapat dicegah. Gaya yang diperlukan untuk mengimbangi desakan zat pelarut yang mengalir melalui selaput semipermeable ke dalam larutan hingga osmosis tepat berhenti disebut tekanan osmosis larutan (∏). Osmosis balik akan terjadi jika tekanan balik diperbesar hingga melebihi tekanan osmosis.
Tekanan osmosis tergolong sifat
koligatif larutan karena harganya bergantung pada konsentrasi dan bukan pada
jenis partikel zat terlarut. Menurut van’t Hoff, tekanan osmosis larutan
encer dapat dihitung dengan rumus yang serupa dengan persamaan gas ideal,
yaitu:























.png)















