Konsep atom pertama kali dikemukakan oleh Demokritos. Namun, konsep atom yang dikemukakan Demokritos tidak didukung oleh eksperimen yang meyakinkan, sehingga tidak dapat diterima oleh beberapa ahli ilmu pengetahuan dan filsafat.
Pengembangan konsep atom-atom melalui eksperimen atau secara ilmiah baru dimulai oleh John Dalton (1805), kemudian dilanjutkan oleh Thomson (1897), Rutherford
(1911) dan disempurnakan oleh Bohr
(1914). Hasil eksperimen yang memperkuat konsep atom ini menghasilkan
gambaran mengenai susunan partikel-partikel tersebut di dalam atom. Gambaran
ini berfungsi untuk memudahkan dalam memahami sifat-sifat kimia suatu atom. Gambaran susunan partikel-partikel dasar dalam atom
disebut model atom. Berikut ini paparan dari masing-masing model
atom tersebut.
1. MODEL ATOM DALTON
Berdasarkan pemikiran bahwa konsep atom Democritus
sesuai dengan Hukum Kekekalan Massa dari Lavoisier (berbunyi: massa zat
sebelum dan sesudah reaksi sama) dan Hukum Perbandingan Tetap dari Proust (berbunyi: perbandingan
massa unsur-unsur dalam suatu senyawa adalah tetap dan tertentu),
maka John Dalton tahun 1805 merumuskan teori atom sebagai berikut.
a.
Materi
tersusun atas partikel-partikel kecil yang disebut atom.
b. Atom-atom
penyusun unsur bersifat identik (sama dan sejenis).
c.
Atom suatu unsur tidak dapat diubah menjadi
atom unsur lain.
d. Senyawa
tersusun atas dua jenis atom atau lebih dengan perbandingan tetap dan tertentu.
e. Pada reaksi kimia terjadi penataulangan
atom-atom yang bereaksi. Reaksi kimia terjadi karena pemisahan atom-atom dalam
senyawa untuk kemudian bergabung kembali membentuk senyawa baru
Hipotesis Dalton digambarkan dengan model atom sebagai bola pejal seperti pada tolak
peluru.
Gambar 1. Model atom Dalton, seperti bola pejal
Dalam perkembangannya tidak semua teori atom
Dalton benar. Kelemahan dari teori atom Dalton tidak dapat menerangkan suatu
larutan dapat menghantarkan listrik. Bagaimana mungkin suatu bola pejal dapat
menghantarkan listrik, padahal listrik adalah elektron yang bergerak. Berarti
ada partikel lain yang dapat menyebabkan terjadinya daya hantar listrik. Karena ada banyak hal yang
tidak dapat diterangkan oleh teori atom Dalton, maka para ilmuwan terdorong
untuk melakukan penyelidikan lebih lanjut tentang rahasia atom.
2.
MODEL ATOM THOMSON
Pada tahun 1897, Joseph John Thomson dari Inggris melakukan serangkaian eksperimen. Melalui
eksperimen dengan tabung sinar katode Joseph John Thomson berhasil menemukan berkas partikel yang bermuatan negatif. Partikel
bermuatan negatif dalam atom ini yang disebut elektron.
Gambar 2. Percobaan Tabung Sinar Katoda
Menurut Thomson, atom berbentuk bulat di mana
muatan listrik positif yang tersebar merata dalam atom dinetralkan oleh
elektron-elektron yang berada di antara muatan positif. Elektron-elektron
dalam atom diumpamakan seperti butiran kismis dalam roti, maka Teori Atom
Thomson juga sering dikenal Teori Atom Roti Kismis.
Gambar 3. Model atom Thomson seperti roti kismis
Thomson juga mampu
menghitung perbandingan muatan terhadap massa elektron. Besarnya muatan dalam elektron ditemukan oleh Robert
Andrew Milikan (1908) melalui percobaan tetes minyak Milikan seperti gambar
berikut.
Minyak disemprotkan ke dalam tabung yang bermuatan
listrik. Akibat gaya tarik gravitasi akan mengendapkan tetesan minyak yang
turun. Bila tetesan minyak diberi muatan negatif maka akan tertarik kekutub
positif medan listrik. Hasil percobaan Milikan dan Thomson diperoleh muatan
elektron -1,6022 x 10-19 Coulomb dan massa elektron 9,10938 x 10-28 gram.
3. MODEL ATOM RUTHERFORD
Pada tahun 1903 Philipp Lenard melalui
percobaannya membuktikan bahwa teori atom Thomson yang menyatakan bahwa
elektron tersebar merata dalam muatan positif atom adalah tidak benar.Kelemahan
dari model atom Thomson
ini tidak dapat menjelaskan susunan muatan positif dan negatif dalam bola atom
tersebut.
Eugene Goldstein (1886) melakukan eksperimen menggunakan tabung sinar katoda yang sudah dimodifikasi, yaitu dengan memberi lubang-lubang pada lempeng katoda.
Gambar 5. Percobaan Goldstein untuk Mempelajari Partikel Positif
Ternyata pada saat terbentuk elektron yang menuju
anoda terbentuk pula sinar positif yang menuju arah berlawanan melewati lubang
pada katoda. Setelah berbagai gas dicoba dalam tabung ini, ternyata gas
hidrogenlah yang menghasilkan sinar muatan positif yang paling kecil baik massa
maupun muatannya, sehingga partikel ini disebut dengan proton.
Penemuan Goldstein ini
didukung dengan penelitian Ernest Rutherford dengan penembakan parttikel alpha pada pelat emas
yang sangat tipis. Dari hasil eksperimennya, ternyata terdapat partikel yang diteruskan, dibelokkan atau dipantulkan.
Berarti di dalam atom terdapat susunan-susunan partikel bermuatan positif dan
negatif. Berdasarkan model
atom Rutherford:
a.
Atom
tersusun dari inti atom yang bermuatan positif pada pusat atom, serta elektron-elektron yang bermuatan
negatif dan bergerak mengelilingi inti,
b.
Sebagian
besar volume atom merupakan ruang kosong,
c. Jumlah
proton dalam inti sama dengan jumlah elektron yang mengelilingi inti, sehingga
atom bersifat netral
Gambar 6. Model atom Rutherford
Berdasarkan
teori fisika, gerakan elektron mengitari inti disertai pemancaran energi
sehingga lama kelamaan energi elektron akan berkurang. Elektron berbeda muatan
dengan inti atom, maka elektron akan
jatuh ke inti. Rutherford belum bisa menjelaskan hal tersebut.
Rutherford juga berhasil menghitung bahwa massa
partikel bermuatan positif itu kira-kira
1.837 kali massa elektron. Pada tahun 1919 partikel tersebut dinamai proton
Massa 1 proton = 1,67262 x 10–24 gram dan muatannya 1,6022
x 10-19 Coulomb. Massa proton = 1 sma (satuan
massa atom) dan muatan proton = +1.
Pada tahun 1932 James Chadwick melakukan
eksperimen penembakan partikel alfa pada inti atom berilium (Be). Dari hasil
percobaan ditemukan adanya partikel bersifat netral atau tidak bermuatan dan
massanya hampir sama dengan proton. Partikel ini disebut neutron .
Gambar 7. Susunan Proton dan Neutron dalam Inti Atom
Massa sebuah neutron adalah 1,67493 ×
10-24 gram, hampir sama atau boleh dianggap sama dengan massa
sebutir proton. Dengan penemuan ini para ilmuwan percaya bahwa inti atom
tersusun atas dua partikel, yaitu proton (partikel yang bermuatan positif) dan
neutron (partikel yang tidak bermuatan). Proton dan neutron mempunyai nama
umum,nucleon. Jadi atom tersusun
atas inti atom (proton dan neutron) dan kulit atom (eletron).
4. MODEL ATOM NIELS BOHR
Kelemahan dari Rutherford diperbaiki oleh
Niels Bohr dengan percobaannya menganalisa spektrum warna dari atom hidrogen
yang berbentuk garis. Hipotesis Bohr adalah :
a.
Atom
terdiri dari inti yang bermuatan positif dan dikelilingi oleh elektron yang
bermuatan negatif di dalam suatu lintasan (orbit).
b.
Elektron
di dalam atom beredar mengelilingi inti atom pada lintasan yang dikenal sebagai
keadaan gerakan yang stasioner (tetap) dengan tingkat energi yang dinyatakan
dengan n (n = bilangan bulat positif 1, 2, 3…)
c.
Sepanjang
elektron berada dalam lintasan stasioner, energi akan konstan. Sehingga tidak
ada energi yang dipancarkan maupun diserap.
d.
Elektron
dapat berpindah dari satu lintasan ke yang lain dengan menyerap atau
memancarkan energi sehingga energi elektron atom itu tidak akan berkurang. Jika berpindah
lintasan ke lintasan yang lebih tinggi maka elektron akan menyerap energi. Jika
beralih ke lintasan yang lebih rendah maka akan memancarkan energi.
Model atom Bohr
digambarkan sebagai berikut.
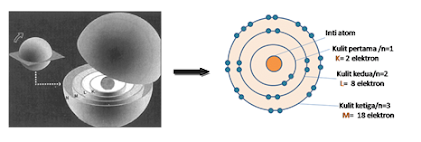
Gambar 8. Model atom Bohr
Menurut model
atom Bohr, atom terdiri dari beberapa kulit/lintasan yang didalamnya terdapat
sejumlah tertentu elektron. Di sisi lain, model atom ini hanya dapat menerangkan atom-atom
yang memiliki elektron tunggal seperti gas hidrogen, tetapi tidak dapat menerangkan
spektrum warna dari atom-atom yang memiliki elektron banyak.
1.
Teori
Atom Mekanika Kuantum
Kelemahan
teori atom Bohr menimbulkan pertanyaan mengapa elektron di dalam atom Bohr
dibatasi untuk mengorbit di sekeliling inti pada jarak tertentu. Pada tahun
1942 ilmuan Louis de Broglie mengemukakan pendapat bahwa ”bila gelombang cahaya
dapat berperilaku seperti aliran partikel (foton) maka partikel seperti
elektron dapat memiliki sifat gelombang”. Hal ini memunculkan sifat dualisme
elektron, yaitu elektron dapat dipandang sebagai partikel dan sebagai
gelombang.
Tidak mungkin menentukan kecepatan sekaligus posisi
elektron dalam ruang secara pasti, yang dapat ditentukan adalah kebolehjadian
menemukan elektron pada jarak tertentu dari inti
atom. Lintasan elektron bukan berbentuk garis tapi sebuah ruang. Elektron boleh
jadi ditemukan dalam ruang itu. Ruang-ruang itu disebut orbital.
Dengan adanya teori probabilitas maka hilanglah
pengertian bahwa elektron beredar mengelilingi inti menurut suatu lingkaran dan
selalu berada pada lingkaran tersebut.
Erwin
Schrodinger seorang ahli fisika dari Austria, berhasil merumuskan persamaan
gelombang untuk menggambarkan gerakan elektron pada atom. Schrodinger
memperhitungkan dualisme sifat elektron, yaitu sebagai partikel dan sebagai
gelombang dalam suatu persamaan yang memperkenalkan mekanisme gelombang. Model
atom dengan menggunakan persamaan gelombang ini disebut model atom modern atau teori
mekanika kuantum.
Menurut
model atom modern, elektron-elektron dalam atom mengelilingi inti atom pada
tingkat energi tertentu. Suatu kulit terdiri atas suatu kumpulan dari satu
orbital atau lebih. Orbital adalah daerah dengan peluang terbesar untuk
menemukan elektron. Berdasarkan teori atom mekanika kuantum, dapat ditentukan
struktur elektronik atom.


























.png)
.png)












