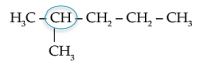SENYAWA TURUNAN
ALKANA
A.
GUGUS FUNGSI
Tabel
(Gugus Fungsi)
Gugus
fungsi merupakan atom atau kelompok atom yang menentukan sifat dan struktur
senyawa karbon.
B.
HALOALKANA
Haloalkana adalah senyawa karbon yang mengandung halogen. Haloalkana
memiliki rumus umum CnH2n+1X. X adalah atom
halogen (F, Cl, Br, I). Dengan kata lain, haloalkana adalah senyawa karbon
turunan alkana yang atom H-nya diganti oleh atom halogen.
Tata Nama Haloalkana
Tata nama senyawa haloalkana diawali dengan kata fluoro, kloro, bromo, atau
iodo dan diikuti nama alkana yang mengikatnya.
|
Rumus
|
Nama
|
|
CH3–CH2–I
|
Monoiodoetana
|
|
CH3–CH2–CH2-CH2Cl
|
Monoklorobutana
|
|
CH2Br–CH2Br
|
1,2–dibromoetana
|
|
CHCl3
|
Triklorometana (kloroform)
|
Isomer
Berdasarkan fakta, haloalkana memiliki isomer posisi dan isomer struktural.
Perhatikan struktur haloalkana berikut.
Kedua senyawa itu memiliki rumus molekul sama, yakni C3H7Cl, tetapi
posisi atom klorin berbeda. Pada 1–kloropropana terikat pada atom karbon nomor
1, sedangkan pada 2–kloropropana terikat pada atom karbon nomor 2. Kedua
senyawa ini dikatakan berisomer satu sama lain, yaitu isomer posisi. Isomer
struktur menyatakan perbedaan struktur dari senyawa haloalkana yang memiliki
rumus molekul sama. Perhatikan struktur molekul berikut dengan rumus molekul
sama, yakni C4H9Cl.
Sifat Haloalkana
a. Sifat Fisika Haloalkana
Senyawa
haloalkana tidak membentuk ikatan hidrogen dan tidak larut dalam air. Sifat
fisika haloalkana lainnya yaitu haloalkana mempunyai titik didih dan titik
leleh lebih tinggi dari alkana yang mempunyai jumlah atom C yang sama. Hal ini
disebabkan adanya penggantian atom hidrogen dengan atom halogen yang mempunyai
massa atom lebih besar daripada hidrogen.
Tabel
1. Titik Didih dan Massa Jenis Haloalkana
|
Rumus
|
Titik Didih
(°C)
|
Massa
Jenis (gr/cm3)
|
Rumus
|
Titik
Didih (°C)
|
Massa
Jenis (gr/cm3)
|
|
CH3Cl
|
-24
|
gas
|
CCl4
|
77
|
1,60
|
|
CH2Cl2
|
40
|
1,34
|
CH3Br
|
5
|
gas
|
|
CHCl3
|
61
|
1,44
|
CH3I
|
43
|
2,28
|
b.
Sifat
Kimia Haloalkana
1. Haloalkana mengalami reaksi substitusi
dengan suatu basa membentuk alkohol.
R – X + MOH → R – OH + MX
Contoh :
CH3Cl + NaOH → CH3 – OH + NaCl
2.
Haloalkana
mengalami reaksi eliminasi dengan pereaksi basa kuat.
Contoh :
3.
Haloalkana
bereaksi dengan logam natrium akan menghasilkan alkana. Reaksi ini disebut
Sintesis Wart.
2RX + 2Na → R – R + 2NaX
4.
Haloalkana
+ magnesium menghasilkan Pereaksi Grignard.
Jika larutan alkil dalam eter kering
dikocok dengan serbuk magnesium, maka akan terjadi pereaksi Grignard. Dari
sintesis inilah Victor Grignard pada tahun 1942 mendapat hadiah Nobel.
Kegunanaan dan dampak haloalkana
1. Haloalkana sebagai zat
anestesi
Kloroform (CHCl3) pernah digunakan secara luas
sebagai zat anestesi (pembius), tetapi kini sudah ditinggalkan. Kloroetana (C2H5Cl)
digunakan sebagai bahan anestesi lokal.
2. Haloalkana sebagai
antiseptik
Iodoform (CHI3) adalah suatu zat berwarna kuning,
berbau khas, dan digunakan sebagai antiseptik.
3. Haloalkana sebagai
pelarut
Tetraklorometana (CCl4) digunakan sebagai pelarut
untuk oli dan lemak serta dalam pencucian kering (dry cleaning).
4. Haloalkana sebagai
bahan pemadam api
Alkana terhalogenasi sempurna, seperti karbon tetraklorida
(CCl4), dan bromoklorodifluorometana (BCF) dapat memadamkan api.
5. Senyawa
klorofluorokarbon (CFC) dan freon
Freon merupakan nama dagang bagi suatu golongan senyawa
klorofluorokarbon (CFC) yang digunakan sebagai cairan pendingin (refrigerant)
atau sebagai propelan aerosol.
6. Berbagai jenis senyawa
haloalkena
Vinilklorida dan kloropena merupakan bahan dasar pada
industri plastik dan karet sintetis.
Walaupun kegunaan
haloalkana sangat luas, akan tetapi penggunaan yang tidak tepat atau berlebihan
akan mengganggu kesetimbangan lingkungan. Contohnya : Penggunaan CFC atau
freon, yaitu gas yang tidak berwarna, tidak berbau, dan tidak terbakar ini
menyebabkan gangguan pada atmosfer, karena di atmosfer CFC menguraikan gas O3
(ozon) menjadi O2. Padahal kita mengetahui bahwa lapisan ozon di troposfer
berfungsi untuk menyaring sinar ultra violet yang menuju bumi. Kelebihan sinar
ultra violet yang mencapai bumi dapat menyebabkan penyakit kanker kulit.selain itu, banyak juga senyawa organo klor yang digunakan sebagai pestisida
sukar terurai sehingga dampak yang ditimbulkan sangat luas dan merusak
lingkungan. Sebagai contoh penggunaan DDT, aldrin yang sukar terurai disamping
dapat membunuh bibit penyakit pada tanaman juga dapat membunuh hewan-hewan air
dan hewan-hewan pemakan bangkai, sebagian lagi terisap oleh tumbuh-tumbuhan dan
masuk ke dalam tubuh manusia. Haloalkana sebagian besar sebagai bahan dasar
pembuatan plastik yang sukar diuraikan oleh mikroorganisme, sehingga pemakaian
plastik dalam kehidupan sehari-hari menimbulkan dampak terhadap lingkungan
terutama pencemaran tanah. Pembakaran sampah plastik juga akan menimbulkan
pencemaran udara. Iodoform (CHI3) yang pernah digunakan sebagai obat luka
berbau tidak enak dan beracun Kloroform (CHCl3) suatu zat cair tidak berwarna
dan berbau sedap dan bersifat membius. Digunakan sebagai pelarut lemak dan obat
bius. Karena sifatnya yang mengganggu hati sekarang diganti halotan (2-bromo-2-
kloro-1,1,1-trifloroetana, CF3-CHClBr).
C.
ALKOHOL (R-OH)
Dalam kimia, alkohol
(atau alkanol) adalah istilah yang umum untuk senyawa organik apa pun yang
memiliki gugus hidroksil (-OH) yang terikat pada atom karbon. Alkohol mamiliki
rumus umum CnH2n+1OH
atau CnH2n+2O. Berdasarkan jenis atom C yang mengikat
gugus -OH, alkohol dibedakan atas alkohol primer, alkohol sekunder, dan alkohol
tersier.
1. Alkohol primer yaitu alkohol yang
gugus fungsinya (–OH) terikat pada atom C primer.
Contoh: CH3– CH2–OH
2. Alkohol sekunder, yaitu alkohol yang gugus fungsinya (–OH) terikat pada
atom C sekunder.
Contoh:
3.
Alkohol tersier, yaitu alkohol yang gugus fungsinya
(–OH) terikat pada atom C
tersier.
Contoh
Tata Nama
Alkohol
Ada dua cara pemberian nama pada alkohol, yaitu:
1. Penamaan secara trivial, yaitu dimulai dengan menyebut nama
gugus alkil yang terikat pada gugus –OH kemudian diikuti
kata alkohol. R - OH (
alkil-alkohol)
Contoh: CH3–CH2—OH Etil
alcohol
CH3–CH2–CH2–OH Propil
alcohol
2. Penamaan secara sistem IUPAC, yaitu dengan mengganti akhiran a pada
alkana dengan akhiran ol (alkana menjadi alkanol)
Contoh : CH3–CH2–OH Etanol
CH3–CH2–CH2–OH Propanol
Urutan Penamaan Senyawa Alkohol menurut IUPAC
1. Menentukan rantai induk, yaitu rantai karbon terpanjang yang mengandung
gugus – OH, selain itu atom karbon lain sebagai cabang.
2. Memberi nomor pada rantai induk yang dimulai dari ujung rantai yang paling
dekat dengan gugus – OH.
3. Urutan penamaan:
a. nomor atom C yang mengikat cabang
b. nama cabang
c. nomor atom C yang mengikat gugus
d. nama rantai induk (alkanol)
4. Penulisan nama cabang sesuai urutan abjad.
5. Apabila posisi gugus –OH ekivalen dari kedua ujung rantai induk, maka
penomoran dimulai dari salah satu ujung sehingga cabang-cabang mendapat nomor
terkecil.
Contoh:
Isomer
1.
Keisomeran
Posisi
Keisomeran posisi, yaitu
keisomeran yang terjadi karena perbedaan letak gugus –OH dalam molekul alkohol.
2.
Keisomeran Optik
Keisomeran optik berkaitan dengan sifat optik, yaitu
kemampuan suatu senyawa untuk dapat memutar bidang cahaya
terpolarisasi.Keisomeran optik terjadi karena adanya atom C asimetrik, yaitu
atom C yang terikat pada 4 gugus yang berbeda.
3. Keisomeran Fungsi
Keisomeran fungsi, yaitu keisomeran yang terjadi karena perbedaan gugus fungsi di antara dua
senyawa yang mempunyai rumus molekul sama. Alkohol berisomer fungsi dengan
eter.
SIFAT ALKOHOL
Sifat alkohol
di kelompokkan menjadi 2 yaitu:
a) Sifat fisik
Alkohol
rantai pendek bersifat polar sehingga dengan baik larut dalam air
serta memiliki titik didih lebih tinggi dibandingkan dengan alkena. Dalam
hal kepolaran dan titik didih, alkohol rantai pendek memilki kemiripan sifat
dengan air. Hal tersebut disebabkan karena air dan alkohol keduanya memilki
gugus -OH. Gugus -OH ini bersifat polar sehingga menyebabkan air dan alkohol
bersifat polar pula. Adapun titik didih yang tinggi disebabkan oleh adanya
ikatan hidrogen antara molekul air, antar molekul alkohol atau antar molekul
air dan alkohol. Ikatan hidrogen ini juga menyebabkan alkohol larut dalam air.
b)Sifat kimia
1. Reaksi dengan Logam Natrium
Alkohol dapat bereaksi dengan logam Na membentuk alkoksida dan gas
hidrogen. Contoh reaksi etanol dengan logam natrium
C2H5 –
OH + Na → C2H5ONa + H2
Etanol Na-etoksida
Reaksi ini
dapat dipergunakan sebagai reaksi untuk pengenal alkohol.
2.
Reaksi Oksidasi
Ø Alkohol primer teroksidasi membentuk aldehid dan dapat teroksidasi lebih
lanjut membentuk asam karboksilat.
Contoh:
Ø Alkohol sekunder teroksidasi membentuk keton.
Alkohol sekunder dioksidasi menjadi keton. Sebagai
contoh, jika alkohol sekunder, propan-2-ol, dipanaskan dengan larutan natrium
atau kalium dikromat(VI) yang diasamkan dengan asam sulfat encer, maka akan
terbentuk propanon.
Ø Alkohol tersier sukar teroksidasi.
3.
Reaksi dengan
Hidrogen Halida
Jika alkohol direaksikan dengan hidrogen halida akan terbentuk
haloalkana dan air dengan reaksi:
R – OH + HX → R – X + H2O
Contoh:
CH3
– OH + HCl → CH3
– Cl + H2O
4.
Reaksi
esterifikasi
Reaksi
esterifikasi berlangsung lambat dan dapat balik (reversibel).
Persamaan untuk reaksi antara sebuah asam RCOOH dengan sebuah alkohol R’OH.
5.
Reaksi Dehidrasi
Alkohol
Alkohol
jika dipanaskan dengan asam kuat, maka akan terjadi alkena dan
air.
Contoh:
CH3– CH2 – CH2 –
OH → CH2 –
CH = CH2 + H2O
n
– propanol 1
– propena
Kegunaan Alkohol
Dalam kehidupan sehari-hari alkohol
banyak digunakan, antara lain sebagai berikut.
1)
Dalam bidang
farmasi (obat-obatan), sebagai pelarut senyawa organik,misalnya etanol
dan butanol.
2)
Dalam bidang
biologi atau industri digunakan sebagai
disinfektan, misalnya etanol dan metanol
3)
Sebagai bahan
bakar, misalnya spiritus (campuran antara methanol dan etanol).
D. ETER
(R-O-R’)
Eter atau alkoksi alkana merupakan turunan alkana yang mempunyai struktur
berbeda dengan alkohol. Eter mempunyai rumus umum R–O–R’ . Dengan gugus fungsi
–O– yang terikat pada dua gugus alkil. Gugus alkil yang terikat dapat sama dan
dapat berbeda.
Tata Nama
Ada dua cara
pemberian nama eter, yaitu:
1. Penamaan secara trivial dimulai dengan menyebut nama alkil yang
terikat pada gugus –O– kemudian diikuti oleh kata eter.
2. Penamaan berdasarkan IUPAC, yaitu penataan
nama senyawa eter dimulai dengan nama gugus alkoksi diikuti oleh nama rantai
utamanya. Gugus alkoksi dianggap sebagai cabang yang terikat pada rantai induk.
Contoh:
|
No
|
Rumus Struktur
|
Tata Nama
|
|
IUPAC
|
TRIVIAL
|
|
1
|
CH3–O–CH3
|
Metoksi metana
|
Metil–metil eter atau Dimetil eter
|
|
2
|
C2H5–O–C2H5
|
Etoksi etana
|
Etil–etil eter atau Dietil eter
|
|
3
|
CH3–O–C2H5
|
Metoksi etana
|
Etil–metil eter
|
Isomer
Eter memilki dua isomer, yaitu isomer struktur dan
isomer fungsional.
1) Isomer Struktur
Isomer struktur ialah senyawa yang memiliki rumus molekul sama, namun rumus
strukturnya berbeda. Contohnya dietil eter memiliki isomer struktur dengan metil
propil eter dan metil isopropil eter.
2) Isomer Fungsional
Alkohol dan eter keduanya memiliki rumus umum yang sama, Akan tetapi,
keduanya memiliki jenis gugus fungsional yang berbeda. Dua senyawa yang
memiliki rumus umum molekul sama namun gugus fungsionalnya berbeda disebut
memiliki keisomeran fungsional. Eter berisomer fungsional dengan alkohol.
SIFAT-SIFAT
ETER
Sifat-sifat
eter yaitu pada keadaan standar, hampir seluruh senyawa eter berwujud cair,
kecuali dimetil eter (gas). Jika dibandingkan dengan senyawa alkohol, titik
didih dan titik leleh eter lebih keci. Ini terjadi karena antar molekul eter
tidak membentuk ikatan hidrogen. Eter juga cenderung bersifat nono polar,
sehingga kelarutannya dalam air sangat kecil. Selain itu eter bersifat mudah
terbakar. Dibandingkan terhadap alkohol, eter jauh kurang reaktif kecuali dalam
hal pembakaran.Eter jauh lebih mantap (lebih kurang reaktif) dibandingkan
alkohol. Eter tidak bereaksi dengan logam natrium. Sifat ini dapat digunakan
untuk membedakan alkohol dengan eter.
Adapun reaksi-reaksi eter yaitu:
d. Reaksi dengan asam-asam mineral
Walaupun eter tahan terhadap
hidrolisis, ia dapat dibelah oleh asam-asam mineral seperi asam bromat dan asam
iodat. Asam klorida hanya membelah eter dengan sangat
lambat. Metil eter umumnya akan menghasilkan metil halida:
ROCH3 + HBr
→
CH3Br + ROH
Reaksi ini berjalan via zat
antara onium, yaitu [RO(H)CH3]+Br–. Beberapa jenis eter dapat terbelah dengan cepat
menggunakan boron
tribomida (dalam beberapa kasus aluminium klorida juga dapat digunakan) dan
menghasilkan alkil bromida.Berganting pada substituennya, beberapa eter dapat
dibelah menggunakan berbagai jenis reagen seperti basa kuat.
Kegunaan dan Dampak Eter dalam Kehidupan
a. Kegunaan
1) Eter digunakan sebagai pelarut.
2) Dietil eter digunakan sebagai obat bius pada
operasi.
3) Metil ters-butil eter (MTBE) digunakan untuk
menaikkan angka oktan bensin.
b. Dampak
Pada konsentrasi rendah, eter dapat menyebabkan pusing kepala,
sedangkan pada konsentrasi tinggi menyebabkan tidak sadarkan diri.